Pemanfaatan unsur dan senyawa dapat menimbulkan dampak negatif terhadap kelangsungan hidup manusia dan alam sekitarnya.
- Struktur dan Komposisi Bumi
Bumi di bagi menjadi lima bagian, yaitu :
· Atmosfir (bagian paling luar) yang tersusun dari campuran berbagai gas.
Atmosfir
merupakan lapisan yang berwujud gas dengan ketebalan 1.100 km dan lebih
dari separoh gas penyusun atmosfir terkomsentrasi pada ketebalan 5,6
km. komposisi gas dari atmosfir semakin tipis bila semakin jauh dari
permukaan bumi. Komposisi atmosfir pada lapisan yang dekat dengan
permukaan bumi menunjukan bahwa gas nitrogen merupakan komponen yang
terbanyak, di susul oleh gas oksigen dan gas-gas yang lain. Gas oksigen
dan nitrogen merupakan dua gas yang banyak di manfaatkan dalam industri,
terutama industri pupuk.
· Hidosfir dengan komponen utamanya adalah air.
Hidrosfir
merupakan lapisan zat cair (air) termasuk larutan yang menutupi 70,8%
permukaan bumi. Hidrosfir selain mengandung air juga terlarut berbagai
senyawa dan ion yang merupakan sumber bahan kimia untuk industri,
misalnya ion natrium dan klorin sebagai larutan NaCl, bromida, iodida,
ion magnesium, dan kalsium.
· Litosfir
merupakan lapisan yang di sebut juga sebagai kerak bumi dengan
ketebalan sekitar 100 km. Kerak bumi tersusun dari berbagai senyawa yang
di kenal sebagai mineral dan bijih. Mineral merupakan senyawaan dari
suatu unsur, sedangkan bijih merupakan mineral yang keya dengan senyawa
tertentu sehingga secara ekonomis dapat di ambil zatnya (sebagai
senyawa atau unsur).
Kerak
bumi mengandung senyawa oksida. Selain senyawa oksida, kerak bumi juga
tersusun dari senyawa karbonat dan senyawa sulfide serta sulfat, tetapi
dengan kadar yang sangat kecil. Bila di hitung secara kelimpahan total
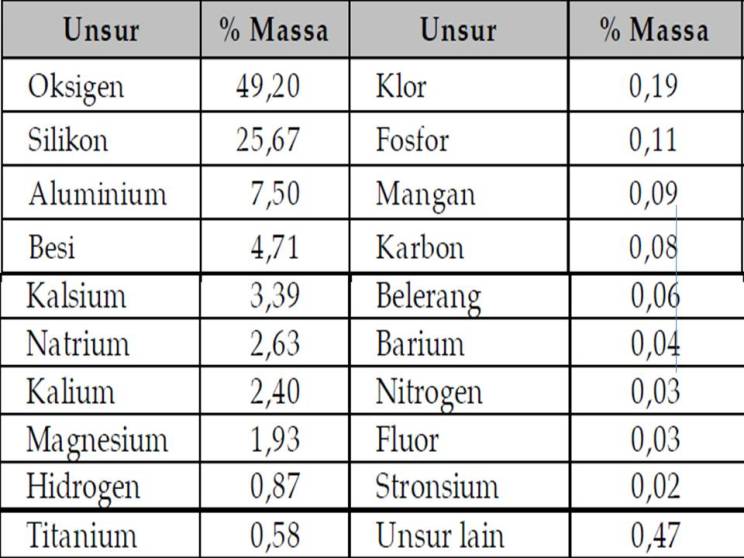
masing-masing unsur, maka oksigen (49,5%) merupakan unsur terbesar
penyusun kerak bumi, silicon (25,7%), aluminium (7,4%), besi (4,7%),
kalsium (3,4%), natrium (2,6%), kalium (2,4%), magnesium (1,9%), dan
titanium, hydrogen dan fosforus mempunyai persentasi kurang dari 1%.
Hampis semua unsur yang ada dalam kerak bumi berada dalam bentuk
senyawa. Kerak bumi merupakan sumber utama dari berbagai zat yang di
butuhkan manusia.
Bagian inti bumi di duga berisi besi cair dan sedikit nikel dan unsur lain, kerapatan inti bumi sangat tinggi (± 13 g cm-3). Dari penelitian seismograf diperkirakan bahwa jari-jari inti bumi mencapai 1275 km, sedangkan suhunya mencapai 6650°C.
- Mineral dan Bijih Tambang di Indonesia
Indonesia
mempunyai deposit bijih unsur-unsur tertentu tang tersebar di berbagai
daerah. Bijih logam terutama aluminium dan timah, serta beberapa bijih
logam transisi (tembaga, emas, mangan, dan perak) tersebar dari Sumatra,
Jawa, Kalimantan, Sulawesi sampai Irian (Papua).
Unsur-unsur
di alam banyak di manfaatkan untuk memproduksi bahan yang berguna bagi
kehidupan manusia. Nitrogen dan oksigen di ambil dengan mencairkan udara
kering. Nitrogen di manfaatkan untuk membuat ammonia yang selanjutnya
di gunakan sebagai bahan baku dalam pembutana pupuk dan bahan peledak.
Gas oksigen di gunakan untuk berbagai keperluan, misalnya dalam proses
pengelasan dan pengoksidasi. Baja merupakan salah satu jenis logam
paduan dengan unsur utama logam besi. Paduan logam besi, kromium, dan
nikel di kenal sebagai baja stainless steel. Baja mangan merupakan paduan logam besi dengan mangan di manfaatkan untuk rel kereta api.
Oleh
karena banyaknya unsur yang ada di alam, maka untuk memahami
sifat-sifatnya di perlukan cara yang sistematis, oleh karena itu di
susunlah system periodik unsur. Pola keteraturan sifat unsure pada
system periodic unsur memberikan andil yang besar dalam memprediksi
keberadaan dan bagaimana cara memisahkan unsur tersebut serta
pemanfaatannya.
Kelimpahan Unsur-Unsur Di Alam
Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga. Unsur nonlogam juga ada yang dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahanbahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan seharihari. Tidak semua mineral dilakukan pengolahan, tergantung besarnya kandungan unsur di dalamnya dan tingkat kesukaran proses pengolahannya. Dewasa ini orang lebih memilih mendaur ulang aluminium bekas daripada mengambil dari bijihnya karena biayanya lebih murah.
Tabel 1 : Kelimpahan Unsur Di Alam
1. Komposisi alkali dalam kerak bumi
Logam alkali termasuk logam yang sangat reaktif. Di alam tidak terdapat dalam keadaan bebas, melainkan dalam keadaan terikat dalam bentuk senyawaUnsur yang paling banyak adalah Na dan K. Kedua
unsur ini banyak terdapat dalam air laut dalam bentuk senyawa NaCl dan KCl.
2. Unsur-unsur alkali tanah tidak terdapat bebas di alam, tetapi terdapat dalam bentuk senyawanya
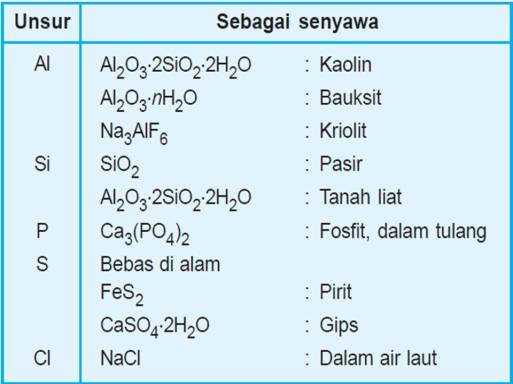
a. Berilium terdapat dalam bijih beril (Be3Al2(SiO3)6).
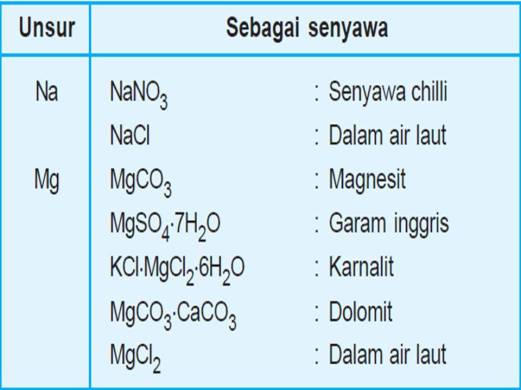
b. Magnesium sebagai dolomit (MgCO3.CaCO3), karnalit (KCl.MgCl2.6H2O).
c. Kalsium sebagai CaCO3 pada batu kapur dan pualam, batu tahu/gipsum (CaSO4.2H2O).
d. Stronsium sebagai stronsianit (SrCO3) dan galestin (SrSO4).
e. Barium sebagai bijih barit (BaSO4).
3. Unsur-unsur periode ketiga di alam
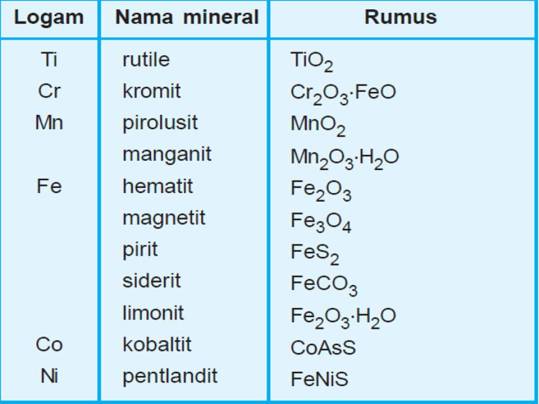
4. Unsur-unsur transisi periode keempat di alam
Di alam unsur-unsur transisi periode keempat terdapat dalam senyawa/mineral berupa oksida, sulfida, atau karbonat. Berikut ini tabel beberapa mineral terpenting dari unsur-unsur transisi periode keempat.

1. Komposisi alkali dalam kerak bumi
Logam alkali termasuk logam yang sangat reaktif. Di alam tidak terdapat dalam keadaan bebas, melainkan dalam keadaan terikat dalam bentuk senyawaUnsur yang paling banyak adalah Na dan K. Kedua
unsur ini banyak terdapat dalam air laut dalam bentuk senyawa NaCl dan KCl.
2. Unsur-unsur alkali tanah tidak terdapat bebas di alam, tetapi terdapat dalam bentuk senyawanya
a. Berilium terdapat dalam bijih beril (Be3Al2(SiO3)6).
b. Magnesium sebagai dolomit (MgCO3.CaCO3), karnalit (KCl.MgCl2.6H2O).
c. Kalsium sebagai CaCO3 pada batu kapur dan pualam, batu tahu/gipsum (CaSO4.2H2O).
d. Stronsium sebagai stronsianit (SrCO3) dan galestin (SrSO4).
e. Barium sebagai bijih barit (BaSO4).
3. Unsur-unsur periode ketiga di alam


4. Unsur-unsur transisi periode keempat di alam
Di alam unsur-unsur transisi periode keempat terdapat dalam senyawa/mineral berupa oksida, sulfida, atau karbonat. Berikut ini tabel beberapa mineral terpenting dari unsur-unsur transisi periode keempat.

#Tambahan
TABEL KOMPOSISI UDARA KERING (DI PERMUKAAN LAUT)
NO
|
GAS PENYUSUN UDARA
|
Kadar (% volum)
| |
Nama
|
Rumus Molekul
| ||
1
2
3
4
5
6
7
8
9
10
|
Nitrogen
Oksigen
Argon
Karbon dioksida
Neon
Helium
Krypton
Hydrogen
Xenon
Gas lainya
|
N2
O2
Ar
CO2
Ne
He
Kr
H2
Xe
(Co, no, so2, dll)
|
78,08
20,95
0,934
0,0314
0,00182
0,000524
0,000114
0,00005
Kurang dari 0,002 %
|
· Hidosfes
merupakan lapisan zat cair (air) termasut laut yang mempunyai meliputi
70,8% permukaa bumi. Selain mengandung air juga terlarut berbagai
senyawa untuk industry missal ion natrium dan klorin sebagai larutan
NaCl, bromide, iodide, ion magnesium dan kalsium
· Litosfer
merupakan lapisab yang disebut juga sebagai kerak bumi dengan ketebalan
sekitar 100km, kerak bumi terdi dari mineral dan biji
TABELL TIPE BEBERAPA SYAWA MINERAL
Tipe Senyawa
|
MINERAL
|
Logam
Karbonat
Halicda
Oksida
Fosfat
Slikat
Sulfat
|
Ag, Au, Bi, Cu, Pd, Pt
Baco3, CaCO3, MgCO3, CuCO3, MgCO3, PbCO3
CaF2, NaCl, KCl, Na3HiF6
Al2O3, 2H2O, Al2O3, Fe2O3, Fe3O4, Cu2O, MnO2
Cu3 (PO4)2, Ca5(PO4)3 OH
Ag2S, ClS, Cu2S
BaSO4, CaSO4, PbSO4, SrSO4, MgSO4, 7H2O
|
TABEL KOMPOSISI KERAK BUMI
NO
|
SENYAWA PENYUSUN
|
Kadar (% masa)
| |
Nama
|
Rumus molekul
| ||
1
2
3
4
5
6
7
8
9
10
|
Silikon krolida
Aluminum kloksida
Besi (ll) oksida
Besi (lll) oksida
Magnesium oksida
Kalsium oksida
Natrium oksida
Kalium oksida
Titanium ( IV) oksida
Fosforus
|
SiO2
Al2O3
Fe2O3
FeO
MgO
CaO
Na2O
K2O
TiO2
P2O5
|
60,18
15,61
3,14
3,88
3,56
5,17
3,91
3,19
1,O6
0,30
|
Selain
itu juga terdapat dua unsure yang disebut unsure jarang (0,1 – 0,02%)
yaitu karbon, mangan,belerang, barium, klorin, kramium, florin, zat
kanium, nikel, trosium dan vanadium.
2.Mineral dan Biji Tambang di Indonesia
Biji
logam terutama timah dan aluminium serta beberapa logam transisi (emas,
tembaga, magan dan perak) tersebar dari Sumatra, jawa, kalimanta,
Sulawesi hingga papua. Unsur – unsure di alam banyak dimanfaatkan untuk
produksi bahan yang berguna lagi bagi kehidupan manusia. Nitrogen
dimanfaatkan untuk membuat ammonia untuk selanjutnya digunakan sebagai bahan baku dalam
pembuatan pupuk dan bahan peledak. Gas Oksigen digunakan untuk berbagai
keperluan seerti dalam proses pengelasan dan proses oksidasi. Paduan
logam besi, kromium, dan nikel dikenal sebagai Stainless stel.
TABE TEMPAT PENAMBANGAN BIJI YANG ADA DI INDONESIA
| |||
Nama unsur
|
Nama Bijian
|
Rumus kimia
|
Daerah penambangan
|
Aluminium
Besi
Emas dan
Perak
Magan
Nikel
Tembaga
Timah
|
Bauksit
Hematik
Magnetic
Siderite
Unsure bebas
Pirolus
Peniandt
Garnierite
Milerit
Kalkopirit
Kasi erit
|
Al2O3, 2H2O
Fe2O3
Fe2O4
FeCO3
Au dan
Ag
MnO2
NIS. FeS
NI.MgSIO3
NIO3
CuFeS2
SnO2
|
P.Bintan – riau singkawang, cilacap
Bankalis, sumatera; Balang Mongondow dan Minahasah
Perbukitan Morelon, lampung, malku
P. serang, Sulawesi selatan, Dongala, Sumsel
Tembagapura, papua
Kep. Riau, Belitung
|
- Sifat-sifat keperiodikan Unsur
Sistem
periodik unsur di susun dengan memperhatikan sifat fisis dan sifat
kimia. Dengan adanya system periodik unsur, sifat-sifat unsur serta pola
keteraturannya dapat di prediksi berdasarkan lataknya dalam system
periodik unsur. Unsur-unsur di dalam system periodik dapat di
kelompokkan dalam blok-blok berdasarkan konfigurasi elektronnya, yaitu
unsur-unsur blok s, blok p, blok d, blok f.
- Sifat fisis
a) Volum dan jari-jari atom
Lothar Meyer
pertama kali menemukan sifat keperiodikan volum atom yang di peroleh
dari angka banding antara massa atom relative (massa molar) dengan
kerapatan atom.
Volum atom = massa molar (g mol-1)
Kerapatan (g cm-3)
Volum atom bergantung
pada tiga factor, yaitu jumlah kulit, tarikan inti terhadap kulit
electron, dan gaya tolak antarelektron pada kulit terluar. Semakin
banyak kulit terluar berada berarti semakin bersar volum atomnya.
Semakin banyak inti atom yang menarik berarti semakin kuat gaya tarik
inti terhadap kulit electron dan mengakibatkan volum atom semakin kecil.
Semakin banyak electron yang menempati suatu subkulit semakin besar
gaya tolak menolak antarelektron dalam orbital tersebut dan akan
berakibat semakin besarnya volum atom. Volum atom berubah secara teratur
dan berulang secara periodic..
Ukuran
atom selain dapat di ketahui dari volum atom juga dapat di ketahui
dari jari-jari atom. Jari-jari atom adalah jarak dari inti sampai ke
electron yang terdapat paling luar. Kesulitan menentukan jari-jari atom
disebabkan pada umumnya atom-atom tidak ada yang berdiri sendiri, tetapi
berkaitan satu sama lain. Jari-jari atom akan mempunyai harga yang
lebih kecil daripada ukuran ion negatifnya, dan akan lebih besar
daripada jari-jari ion positfnya.
b) Titik didih dan titik lebur
Meleleh merupakan peristiwa merenggangnya jarak antaratom dari suatu unsure. Oleh
karena itu, titik leleh bergantung pada kekuatan relative ikatan
antaratom. Kekuatan ikatan pada unsur-unsur logam dipengaruhi oleh
electron valensi logam bersangkutan. Semakin banyak electron valensi
logam, kekuatan ikatan logam bertambah, sehingga pada unsur-unsur logam
semakin ke kanan dalam satu periode semakin tinggi titik lelehnya.
Unsur-unsur
nonlogam yang terikat melalui ikatan kovalen yang kuat dengan membentuk
struktur molekul raksasa, misalnya karbon dan silicon, mempunyai titik
leleh yang sangat tinggi; sedangkan molekul-molekul nonlogam yang
terikat melalui ikatan kovalen dengan membentuk molekul sederhana, titik
lelehnya di pengaruhi oleh gaya ikatan antarmolekul, yaitu gaya Van der
Waals. Semakin besar ukuran molekulnya semakin kuat gaya Van der Waals
yang bekerja dan mengakibatkan titik lelehnya semakin tinggi.
Keperiodikan
titik leleh dan titik didih mempunyai pola yang teratur. Dalam satu
periode dari golongan IA sampai golongan IVA cenderung naik dan turun
secara tajam pada golongan VA, kemudian turun secara teratur sampai
golongan gas mulia (golongan VIIIA). Keperiodikan titik didih mempunyai
pola yang sama dengan pola perubahan titik lebur.
c) Energi ionisasi
Energi
ionisasi (EI) atau potensial ionisasi adalah besarnya energi yang di
perlukan oleh suatu atom dalam wujud gas untuk melepaskan electron yang
terikat paling lemah. Energi ionisasi pertama (EI1) merupakan besarnya energi yang diperlukan untuk melepaskan electron yang pertama, dan energi ionisasi kedua (EI2) merupakan energi yang diperlukan untuk melepaskan electron yang kedua atau dari suatu kation yang bermuatan +1.
Mg(g) ® Mg+(g) + e- EI1 = 738 kJ mol-1
Mg(g) ® Mg2+(g) EI2 = 1451 kJ mol-1
Besarnya
energi ionisasi dipengaruhi oleh ukuran atom (jari-jari atom), muatan
inti, dan efek pelindung kulit electron dan kedudukan electron dalam
orbital electron. Semakin besar jari-jari atom semakin lemah gaya tarik
inti terhadap electron, akibatnya electron semakin mudah dilepas. Hal
itu berarti untuk melepaskan electron hanya di perlukan sedikit energi
(energi ionisasinya kecil).
Beberapa
jenis electron akan terikat lebih kuat karena adanya efek pelindung
oleh subkulit electron yang lain. Electron yang sudah berpasangan di
dalam suatu orbital lebih kuat terikat oleh inti karena adanya pengaruh
perlindungan electron dari pasangannya.
d) Affinitas electron
Affinitas
electron adalah energi yang dilepaskan jika suatu atom dalam wujud gas
menerima (menarik) electron membentuk ion negative. Besarnay affinitas
electron suatu atom di pengaruhi oleh ukuran dan muatan inti. Harga
affinitas electron suatu atom ditentukan secara tidak langsung, sebab
ada beberapa atom yang mempunyai kecenderungan membentuk ion positif
sehingga tidak mungkin di paksa untuk menjadi ion negatif tanpa melalui
pembentukan ikatan dengna atom yang lebih elektropositf. Oleh karena
itu, beberapa atom tidak diketahui harga affinitas elektronnya, misalnya
gas mulia.
e) Keelektronegatifan
Keelektronegatifan
suatu atom menunjukan kecenderungan suatu atom untuk menarik pasangan
electron yang digunakan bersama dalam pembentukan ikatan dengan atom
lain. Atom yang mempunyai kemempuan menarik pasangan electron lebih kuat
daripada atom yang berkaitan dengannya diberi harga skala
keelektronegatifan lebih besar. Terdapat beberapa criteria skala yang
digunakan untuk menyatakan harga keelektronegatifan suatu unsur,
misalnya skala Pauling atau skala Huggins, skala Mullikan, dan skala
Sanderson.
f) Sifat magnetic
Sifat magnet suatu atom unsure berkaitan dengan struktur elktronnya, sesuai dengan aturan aufbau, larangan Pauli, dan aturan Hund.
Electron di dalam orbital suatu atom ada yang berpasangan dan ada yang
tidak berpasangan. Beberapa atom misalnya atom-atom gas mulia semua
elektronnya berpasangan, tetapi beberapa atom yang lain tidak
berpasangan. Akibat dari kedua keadaan tersebut berakibat pula pada
interaksinya terhadap medan magnet. Atom-atom yang semua elektronnya
telah berpasangan cenderung ditolak oleh medan magnet dan disebut
sebagai atom diamagnetic, sedangkan atom-atom yang mempunyai electron tidak berpasangan akan tertarik oleh medan magnet dan disebut atom yang bersifat paramagnetic.
Adanya electron yang tidak berpasangan menimbulkan momen magnet yang diukur dalam satuan bohr-magneton (BM). Besarnya momen magnet dapat di perkirakan dengan rumus :
µ = Ön(n+2)
dengan, µ = momen magnet dalam bohr-magneton
n = jumlah electron tidak berpasangan
- Sifat kimia
a) Pola kereaktifan unsure dalam system periodic
Golongan
IA dan IIA sangan reaktif disebabkan unsur-unsur tersebut mempunyai
energi ionisasi rendah, sehingga mempunyai kecenderungan mudah membentuk
ion positif (kation). Unsur-unsur golongan VIIA juga sangat reaktif
karena affinitas elektronnya tinggi sehingga mempunyai kecenderungan
untuk menarik electron dan menjadi electron negatif (anion).
Unsur-unsur
blok s semakin besar nomor atomnya semakin reaktif, sebab energi
ionisasinya semakin kecil; sedangkan unsur-unsur blok p (kecuali gas
mulia) mempunyai kecenderungan semakin kebawah dalam satu golongan
menjadi kurang reaktif. Beberapa unsur transisi (blok d) sangat stabil
terutama unsure golongan IB (Cu, Ag, dan Au) dan beberapa unsur lainnya,
misalnya Pt dan Hg.
b) Kelarutan senyawa dan pola kecenderungannya
Kelarutan
suatu zat di dalam air dipengaruhi oleh beberapa factor, antara lain
ukuran partikelnya (molekul atau ion), energi kisi kristalnya dan energi
hidrasinya. Zat dengan ukuran partikel besar umumnya lebih sukar larut
daripada zat-zat dengan ukuran pertikel yang lebih kecil, karena tampak
pada kecenderungan kelarutan garam sulfatdari golongan alkali tanah yang
semakin kecil dari Mg ke Ba. Energi kisi merupakan energi yang dilepas
apabila ion-ion gas bergabung membentuk kristal ionic, sedangkan energi
hidrasi adalah energi yang dilepas apabila ion-ion gas terlarut dalam
air.
Struktur
kristal suatu zat juga dapat berpengaruh terhadap kelarutan suatu zat.
Struktur kristal adalah khas (unik) untuk suatu zat, sehingga apabila
suatu zat yang segolongan mempunyai struktur kristal yang berbeda akan
dapat menimbulkan penyimpangan pada pola kecenderungan kelarutannya.
c) Keperiodikan sifat asam dan basa
Kekuatan asam dan basa dapat diprediksi dari kekuatan ikatan antara proton (H+) dengan gugus atom pusat yang mengikatnya. Semakin
kuat ikatan terhadap proton semakin lemah sifat suatu asam. Berdasarkan
hal tersebut, untuk asam biner (HX) akan semakin kuat sifat asamnya
bila jari-jari atom X semakin besar, sebab semakin besar jari-jari
atomnya semakin lemah gaya tarik atom X terhadap atom H dan atom H akan
mudah terlepas sebagai proton (H+). Berdasarkan hal tersebut dalam satu golongan asam binernya semakin kuat dengan naiknya nomor atom (makin ke bawah).
Untuk
asam oksi (HOX), kekuatan asam ditentukan oleh keelektronegatifan X,
sebab semakin elektronegatf ikatan O-X semakin kuat, sehingga ikatan H-O
menjadi lemah dan mudah melepas proton (H+). Apabila X merupakan atom yang elektropositf maka yang akan terlepas adalah gugus OH- yang mengakibatkan bersifat basa. Berdasarkan hal tersebut maka sepanjang periode semakin ke kanan letak unsur asam oksinya akan semakin kuat.
d) Daya mempolarisasi dan terpolarisasi
Daya
mempolarisasi kation ditentukan oleh perbandingan muatan kation
terhadap jari-jari kation. Daya polarisasi ini kuat bila muatan ionnya
besar, tetapi jari-jari kationnya kecil. Sebaliknya, ukuran dan muatan
anion semakin besar akan semakin mudah anion tersebut mengalami
polarisasi. - Sifat Keperiodikan Unsur
|
|
9
comments


9 comments:
bsa di jelskn scra trperinci, unsur kimia yg dpt di tmbang, sperti sipatx, cra penambangan, metode pnmbngan, pengolahan, bentuk pisikx, maupun hasil dan produknya...
makasiiii
Nice post :D
sip
sip
chenlina20150827
ray ban sunglasses
adidas original trainers
oakley sunglasses
kd shoes
coach factory outlet
coach canada outlet
adidas superstars
louis vuitton outlet
toms outlet
oakley outlet
coach outlet online
louis vuitton handbags
louis vuitton handbags
mont blanc pens
uggs on sale
north face jacket
ray ban sunglasses
jordan 3 retro
oakley store
louis vuitton
louboutin pas cher
ghd hair straightener
abercrombie & fitch
uggs for men
coach factorty outlet
oakley sunglasses
coach outlet online
nike sb janoski
giuseppe zanotti outlet
kids lebron james shoes
oakley sunglasses
fitflops sale
jordan 8s
michael kors handbags
abercrombie
jordan retro 11
louis vuitton handbags
true religion jeans
hollister
jordans
as
marc jacobs
ray-ban sunglasses
toms shoes
coach factory outlet
canada goose jackets
fitflops sale clearance
ugg boots
longchamp outlet
ray ban sunglasses
louis vuitton bags
louboutin pas cher
jordans for sale
ralph lauren polo
the north face jackets
ugg clearance
michael kors outlet stores
timberland boots
louis vuitton handbags
timberland boots
michael kors outlet online
louis vuitton outlet
jordans
coach outlet online
hollister jeans
cheap oakley sunglasses
hollister
coach outlet store online
christian louboutin outlet
adidas originals
toms
ralph lauren outlet
tods outlet
20151221yuanyuan
Obat Raja Singa Di Apotek ? Segera Hubungi Kami Dan Pesan Obatnya Sekarang Juga di Fast Respond : 087705015423 PIN : 207C6F18.
moncler jackets
ugg outlet
ralph lauren outlet
nike air huarache
chargers jerseys
ralph lauren outlet
rolex watches
louboutin shoes
michael kors handbags
ralph lauren
Sistem periodik unsur di susun dengan memperhatikan sifat fisis dan sifat kimia. Dengan adanya system periodik unsur, sifat-sifat unsur serta pola keteraturannya dapat di prediksi berdasarkan lataknya dalam system periodik unsur. Unsur-unsur di dalam system periodik dapat di kelompokkan dalam blok-blok berdasarkan konfigurasi elektronnya, yaitu unsur-unsur blok s, blok p, blok d, blok f.
pakistani stitched suits wholesale
stitched pakistani suits online
Komentar di: Kelimpahan Unsur di Alam dan Sifat Keperiodikan Unsur
Berkomentarlah dengan sopan dan pastikan komentar anda bukan spam. Komentar spam akan dihapus.